
“Non mi aspettavo una disattenzione così comune e diffusa”, intervista a Federica Bevilacqua, vincitrice della Menzione Speciale della V edizione del Premio previsto dal Bando intitolato a “Elena Lucrezia Cornaro Piscopia Università di Padova”
Federica Bevilacqua, Alumna di Farmacia dell’Università di Padova e specializzata in Ricerca e sviluppo preclinico e clinico dei farmaci all’Università di Milano – Bicocca, vincitrice della Menzione Speciale della V edizione del Premio previsto dal Bando intitolato a “Elena Lucrezia Cornaro Piscopia Università degli Studi di Padova”.
Una menzione destinata ai lavori di ricerca che abbiano come oggetto integrazione alimentare, nutrizione umana, nutraceutica e alimentazione funzionale per la corretta fisiologia della persona e/o per aumentati fabbisogni nutritivi.
Buongiorno Federica, e congratulazioni per questo riconoscimento ottenuto grazie al tuo elaborato presentato, dal titolo “Critical analysis of the evolution of clinical trial inclusion diversity around the world”. Che cosa hai affrontato in questa ricerca?
L’obiettivo della mia ricerca è stato fotografare la situazione attuale delle sperimentazioni cliniche dapprima in Italia, poi nel contesto europeo e Stati Uniti, per andare a guardare chi sono davvero i pazienti arruolati, suddivisi per le loro caratteristiche. Inoltre, ho voluto analizzare le linee guida riguardanti il tema dell’inclusione emanate dalle agenzie regolatorie: FDA (Food and Drug Administration) per USA, EMA (European Medicines Agency) per l’Europa ed AIFA (Agenzia Italiana del Farmaco) per l’Italia, soffermandomi su come e quanto preservino e promuovano la patient diversity and inclusion.
Quali sono le conclusioni a cui sei arrivata? Ti saresti mai aspettata questo risultato?
Negli ultimi anni sono stati fatti indubbiamente molti passi avanti per quanto riguarda la medicina di genere, dando maggiore importanza alle differenze biologiche (basate sul sesso), socioeconomiche e culturali (basate sul genere) dei singoli individui e analizzando come tali differenze influenzano la salute in varie declinazioni: nello sviluppo o nella progressione dei segni clinici di malattia, nella risposta al trattamento e ai possibili eventi avversi correlati, al fabbisogno di nutrienti. Lo sviluppo di integratori personalizzati per i due sessi ne è un esempio. Ho riscontrato lacune nella raccolta di dati stratificati, al di là del semplice “sesso maschio o femmina”, in quanto vengono trascurate importanti e significative informazioni in termini di età, razza, gruppo etnico, comorbidità, stato di gravidanza, stato di allattamento, disabilità e condizione socio-economico; tutte caratteristiche da tenere in considerazione in fase di disegno di un trial clinico affinché la popolazione campione riproduca il più possibile quella esposta al farmaco una volta approvato. Confesso che non mi aspettavo una “disattenzione” così comune e diffusa.
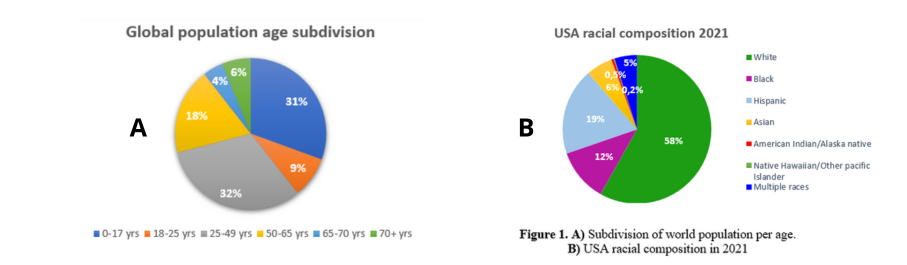
Questi riscontri che hai ottenuto dal tuo lavoro sono applicabili ad ogni tipo di farmaco? Ci sono diversità tra diversi paesi del mondo?
Impossibile avere popolazioni di studio portatrici di tutte queste diversità, peraltro non sempre tutte necessarie. Ciò perché va considerata anche l’epidemiologia della malattia, cioè chi sono i pazienti maggiormente colpiti, e va fatta un’accurata valutazione volta per volta.
In Europa rispetto agli Stati Uniti il tema della diversità è, per ora, meno sentito. L’FDA ha emanato una serie di linee guida che suggeriscono come ottenere una maggior inclusione, mentre l’EMA cita solo alcuni dei criteri di cui vi ho parlato. Un esempio sono etnicità e razza: spostamenti lavorativi e flussi migratori rendono questi dettagli ogni giorno più importanti e necessari.
Quali sono le implicazioni etiche della diversità nei trial clinici, soprattutto considerando gruppi vulnerabili e storicamente sotto-rappresentati?
Si potrebbe esporre popolazioni fragili ad un rischio non ancora noto. Quando si prescrive un farmaco si considera il rapporto rischio-beneficio; se però gli eventi avversi non sono stati studiati su un campione diversificato di pazienti, questo rapporto potrebbe non essere stimato accuratamente. Con l’approvazione di un farmaco si afferma (negli stati che lo autorizzano ma potenzialmente alla popolazione mondiale) che il farmaco è sicuro su tutti. La maggior parte dei farmaci in passato furono testati solo su giovani uomini bianchi di 70 kg, perciò le eventuali differenze di risposta ed effetti collaterali divennero noti solo una volta prescritti ad una grande platea di pazienti. Se si vuole una medicina più inclusiva, ciò dovrebbe accadere sempre più di rado.

Come poter includere le “differenze” nel prossimo futuro?
In fase di studio clinico bisogna innanzitutto prevedere strategie per raggiungere popolazioni svantaggiate ed escluse. In questa direzione l’FDA si sta attivando con delle linee guida che suggeriscono alle aziende farmaceutiche strumenti e modalità per rendere gli studi clinici i più inclusivi possibili.
Allo stesso modo, massima attenzione deve essere prestata durante la redazione dei criteri di inclusione ed esclusione, affinché non siano troppo stringenti e sempre motivati. Tutto ciò deve inoltre essere affiancato da una campagna di informazione rivolta sia a tutte le figure che partecipano alla sperimentazione e alla raccolta di dati, per farlo nel modo più dettagliato e statisticamente significativo, sia ai pazienti che forniscono le informazioni.
Grazie Federica per aver condiviso con il nostro pubblico il tuo ampio lavoro e le sue implicazioni e prospettive. Continuerai a fare ricerca in quest’ambito? Cosa ti aspetta per il futuro?
Si assolutamente. La curiosità su questo argomento mi è nata sul campo durante uno stage in ricerca clinica presso una Contract Research Organization (CRO, azienda che fornisce servizi alle aziende farmaceutiche durante lo sviluppo di nuovi farmaci), che mi ha da poco accolto nelle sue fila con il ruolo di Clinical Research Associate. Il ruolo consiste nel supportare i centri ospedalieri durante lo svolgimento dei trials fungendo da ponte tra aziende farmaceutiche e personale sanitario. Diventare tutti ogni giorno più consapevoli e sensibili su queste differenze rappresenta l’indispensabile premessa per una ricerca di carattere inclusivo e che sia specchio della realtà.
Scopri com’è andato l’evento di premiazione lo scorso 26 giugno.
Combattere le discriminazioni, anche nella tecnologia: “Una Giornata con Elena– 2023”

